|
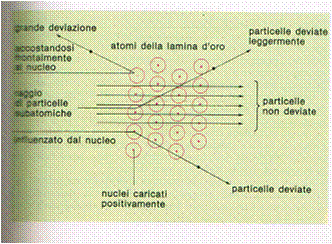
Appendice 1: Conclusioni Come osservazione conclusiva si può notare che tutti i modelli atomici discussi presentano grandi difficoltà teoriche relative a stabilità meccanica ed elettromagnetica, anche se la presenza di instabilità nel modello poteva servire a spiegare il comportamento delle sostanze radioattive. Per tale motivo negli anni 1912-1913 Lord Rutherford riunì un gruppo di fisici, tra i quali c’era anche N. Bohr. Questo gruppo di ricercatori sviluppò attraverso ipotesi ed esperimenti, la nuova concezione della struttura atomica: l’atomo si pensò costituito da un nucleo centrale carico positivamente, circondato dagli elettroni. Essi sottoposero una lamina d’oro molto sottile ad un flusso di particelle subatomiche, e notarono che la maggior parte di queste attraversavano indisturbate la lamina. Dall’osservazione di H. Geiger e E. Marsden che una sottile lamina d’oro sottoposta ad un flusso di particelle subatomiche, non devia la traiettoria della maggior parte delle particelle, Rutherford dedusse che l’atomo era costituito maggiormente da spazio vuoto. Si osservò anche che una frazione di particelle tornava indietro. Rutherford ipotizzò perciò che nello atomo ci fosse un ‘’cuore’’molto piccolo,che conteneva tutte le cariche positive e quasi tutta la massa dello atomo. |
|
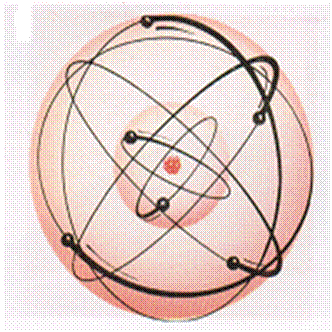
Rutherford e Bohr considerarono gli elettroni come in ‘’orbita’’ intorno al nucleo allo stesso modo della Terra intorno al Sole. Il modello atomico di Rutherford e Bohr fu talvolta chiamato modello atomico planetario. Bohr introdusse ,in più rispetto a Rutherford, degli opportuni postulati grazie ai quali riuscì a ottenere una precisa previsione degli spettri a righe. Secondo questo modello, l’atomo di idrogeno poteva essere considerato simile ad un sistema solare costituito da un Sole ed un solo pianeta. Il modello di Bohr utilizzava la teoria quantica che era stata enunciata dal tedesco M. Planck secondo cui la energia non era emessa in modo continuo, ma in piccoli pacchetti o quanti (detti fotoni). Un quanto di energia (di radiazione elettromagnetica ) era correlato alla frequenza ν di emissione dall’ equazione E = h v dove h è una costante denominata costante di Planck, il cui valore è 6.63*10-34 j/Hz. Bohr osservò che lo assorbimento di radiazioni da parte dell’idrogeno, ad una determinata lunghezza d’onda, comportava definiti cambiamenti di energia del suo elettrone. Egli ideò che le orbite degli elettroni che circondavano un nucleo avessero diametri definiti e che gli elettroni potessero occupare solo determinate orbite. Le sole orbite permesse erano quelle le cui differenze energetiche uguagliavano l’energia assorbita quando l’atomo era eccitato. Applicando le leggi della fisica classica, Bohr introdusse il primo dei suoi due postulati: “il valore del modulo del momento della quantità di moto dell’ elettrone che ruota intorno al nucleo deve essere un multiplo intero di h/2π “, dove h è la costante di Planck : m v r = n h / 2π con n = 1,2,.., |
|
Copyright © I.S.H.T.A.R. – December 2008 |