 Animazione
Animazione
Prima Legge di Fick: punto di vista cinetico
Analisi Quantitativa
PRIMA LEGGE DI FICK : PUNTO DI VISTA CINETICO
(Inizio pagina )
Consideriamo un cilindro riempito con due soluzioni della stessa sostanza, posto in un termostato alla temperatura costante T. Un pistone permeabile alle molecole del solvente, ma non a quelle del soluto, divide il cilindro in due parti, contenenti le due soluzioni A e B. La soluzione A è meno concentrata della B.
Il coefficiente di diffusione D dà il numero delle moli che si diffondono nell'unità di tempo attraverso una sezione di area data, per una determinata variazione di concentrazione.
Il moto delle singole particelle è soggetto alle leggi fondamentali della meccanica del punto materiale, ma non manifesta alcuna direzione preferenziale.
Metà delle molecole aderenti sui due lati dello strato considerato si muove verso sinistra, la restante metà verso destra. Siccome il loro numero è, per ipotesi, maggiore a sinistra che a destra allora, attraverso il setto di separazione, si sposterà un maggior numero di particelle da sinistra verso destra cioè verso il lato della soluzione diluita, rispetto alla direzione opposta. Questo processo termina soltanto quando la concentrazione diventa uguale in tutte le parti della soluzione in modo da avere una completa compensazione dei moti delle particelle nei due sensi attraverso il setto di separazione.
Conseguentemente, se nella camera A il soluto si trova in concentrazione maggiore che nella B, sul pistone si esercita una forza pari al prodotto della differenza tra le pressioni osmotiche nei due scomparti, moltiplicata per la superficie S del pistone stesso. Ne segue che il pistone si muove verso destra, filtrando il solvente, fino a che la concentrazione di soluto nei due scomparti diventa uguale.
 Animazione
Animazione
La forza che tende a rendere uguale la concentrazione nei due scomparti, provocando la diffusione del soluto fino ad occupare volumi in grado di realizzare la suddetta uguaglianza di concentrazione, è appunto detta ``pressione osmotica''.
Il processo di diffusione può essere arrestato applicando dall'esterno una forza F uguale e contraria a quella dovuta alla differenza di pressione osmotica.
 Animazione
Animazione
ANALISI QUANTITATIVA
(Inizio pagina )
Supponiamo ora di togliere il setto di separazione della soluzione a concentrazione maggiore da quella a concentrazione minore.
Ricordando l'analogia che lega il moto delle particelle di soluto tra quelle del solvente a quello delle particelle che costituiscono un gas perfetto, la forza che provoca il movimento diffusivo sarà:

dove R è la costante dei gas.
A questo punto, nota la forza che provoca il movimento diffusivo, occorre
determinare la resistenza che si oppone a tale movimento.
Avendo adottato il modello di Einstein,
la resistenza 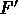 offerta al movimento delle molecole di soluto da parte di quelle del solvente è data dalla
relazione di Stokes.
offerta al movimento delle molecole di soluto da parte di quelle del solvente è data dalla
relazione di Stokes.
La 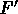 agisce in opposizione a F, crescendo via via che F accelera le molecole, aumentandone la velocità,
sino ad una
agisce in opposizione a F, crescendo via via che F accelera le molecole, aumentandone la velocità,
sino ad una  per la quale F ed
per la quale F ed 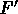 risultano uguali e contrarie.
In un volume unitario di soluzione sono contenute nN molecole di soluto, dove N è il
numero di Avogadro ed n il numero di moli, dunque la forza
risultano uguali e contrarie.
In un volume unitario di soluzione sono contenute nN molecole di soluto, dove N è il
numero di Avogadro ed n il numero di moli, dunque la forza 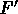 (che agisce su una molecola),
prima di essere uguagliata a F deve essere moltiplicata per il numero di molecole.
(che agisce su una molecola),
prima di essere uguagliata a F deve essere moltiplicata per il numero di molecole.

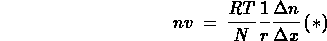
Avendo imposto la condizione di equilibrio dinamico  è possibile ricavare la velocità delle molecole in questa
condizione:
è possibile ricavare la velocità delle molecole in questa
condizione:

Confrontando la (*) con la prima legge di Fick si osserva immediatamente che, a
meno di un volume e di una mole, 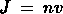 e
e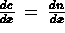 . Risulta quindi, ricordando la relazione di
Stokes:
. Risulta quindi, ricordando la relazione di
Stokes:

La teoria conduce quindi ad una precisa espressione per prevedere il valore del coefficiente di diffusione in funzione solamente della temperatura, della viscosità del solvente e del raggio della molecola sferica del soluto.
La stessa relazione consente di determinare le dimensioni geometriche delle molecole del soluto , una volta che si sia determinato, con i metodi descritti nella sezione dedicata all'analisi macroscopica, il suo coefficiente di diffusione.

La permeazione attraverso le membrane

Ritorna al modello di Einstein
 Note
Note
 Indice
Indice